|
|

樓主 |
發表於 2016-8-4 10:45:23
|
顯示全部樓層
轉貼2016年3月21日經濟日報,供同學參考
智擎胰臟癌藥 拚歐亞取證
經濟日報 記者黃文奇/台北報導
智擎催速,拚年底亞洲取證。智擎表示,抗胰臟癌新藥「安能得」(ONIVYDE)亞洲藥證拚第2季遞件,有機會在今年第4季取證。法人指出,智擎後續仍有6,000萬美元的里程碑款,若在今年順利認列,則整體稅後純益上看20億元。
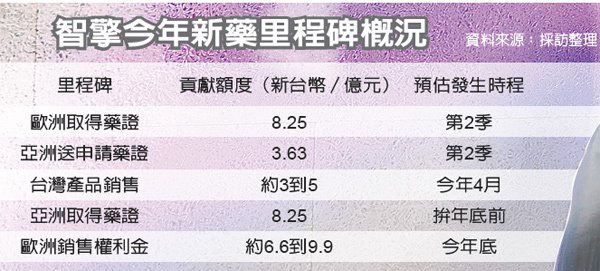
智擎今年新藥里程碑滿滿,包括歐洲取證、亞洲遞件、亞洲取證,還有台灣銷售及歐、亞銷售里程碑款也可望認列,換言之,智擎今年的每股稅後純益(EPS)穩坐15元、有機會超過20元。
在確定的純益貢獻方面,智擎今年約3,600萬美元(約新台幣11.9億元)確定在今年落袋,包括歐洲取證2,500萬美元,亞洲送件將獲1,100萬美元的里程碑款,這還不計台灣銷售部分。
另外,若今年歐洲取證後銷售順利,則依約第一年的「銷售里程碑款」則有2,000萬美元到3,000萬美元不等的進帳,法人指出,如果亞洲今年也能在第4季順利取證,可以再認列約2,400萬美元的里程碑款。
所謂銷售里程碑款,是智擎與歐洲夥伴Baxter所簽署再授權協定中的條款,未來「安能得」若能順利在歐亞銷售告捷,智擎有1.3億美元銷售權利金可分批認列,還不包括銷售分潤。
智擎透露,依安能得在美國的銷售熱度,這個權利金應是「穩拿」,未來三年將逐年遞增、分批認列,今年認列的金額約2,000萬美元到3,000萬美元間(約新台幣6.6億到9.9億元)。
智擎除了有信心於下季同步在歐洲取證,內部透露,安能得正申請進口並布建通路,下個月在台上市。法人估,胰臟癌末線用藥國內市場約10億元,智擎可望獨吞,今年銷售額則粗估3億到5億元以上,純益粗估在1.5億到2億元間。
智擎表示,公司今年營運在產品銷售、授權領域都很有信心,尤其,安能得除了拚胰臟癌一線用藥,另在胃癌、大腸癌領域仍大有可為,因此公司產品動能將逐季逐年增溫,加上公司其他產品線持續擴大,智擎今年營運會讓投資人眼睛一亮。
台灣市場方面,台灣目前擁有1,700位胰臟癌病患,其中600位是末線患者在排隊使用安能得;該產品單支價格5.5萬元,兩周打三針、需打八次,一次療程概算約132萬元,600病患一年的花費則約當8億元。
評析
智擎後續仍有6,000萬美元的里程碑款,若在今年順利認列,則整體稅後純益上看20億元。
|
|