|
|

樓主 |
發表於 2018-6-3 15:10:56
|
顯示全部樓層
轉貼2017年1月16日經濟日報,供同學參考
健永植物藥 授權商機大
經濟日報 記者黃文奇/台北報導
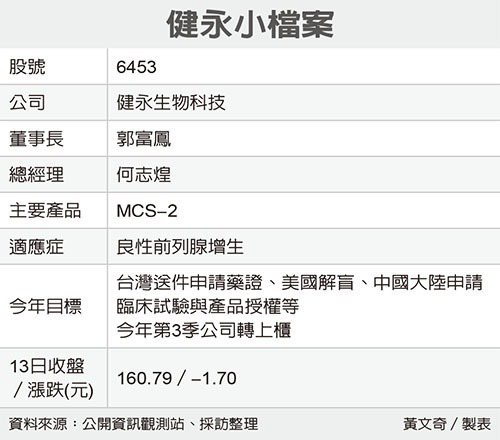
興櫃公司健永生技(6453)旗下治療良性前列腺藥增生(BPH)用藥MCS-2去年在台臨床三期解盲成功,董事長郭富鳳表示,預計今年送申請台灣、中國大陸臨床試驗並完成美國解盲。此外,公司近期積極洽談大陸藥廠洽談授權,法人估,前期權利金至少2,000萬美元起跳。
到去年為止,美國食品藥物管理署(FDA)有600多件植物藥新藥的臨床試驗案,MCS-2是唯一的前列腺用藥。植物藥市場潛力極高,目前全球僅有兩家藥廠以植物藥取得藥證,健永的MCS-2可望有機會名列全球前五名獲FDA核准的植物用藥。
從BPH藥物市場規模來看,歐美日總合約57億美元;大陸約人民幣45億元,大陸複合成長率達11.8%。更重要是目前沒有能完全治癒BPH的藥物,且現有用藥副作用高,這也是MCS-2競爭利基。以下是專訪紀要:
問:健永MCS-2三期解盲後,今年的主要規劃?
答:健永今年有幾項里程碑,首先是MCS-2台灣藥證申請,這在年中前應該可以完成,再來就是大陸的臨床申請,以及美國臨床試驗解盲、授權;而內部預期今年大陸將可完成授權。健永規劃今年第3季完成上櫃,目前這些藥證等相關規劃都會拚在上櫃前完成。
至於大陸的臨床試驗方面,目前已找好醫師、醫院,基礎工作已經完成,下一步是遞件申請臨床。此外,健永與大陸大藥廠洽談銷售合作(授權),前期權利金可望超過2,000萬美元,預估銷售市場規模達人民幣數十億元。
MCS-2三期解盲 效果顯著
在授權對象方面,過去大陸幾個大藥企曾來健永洽談合作,包括國藥、華潤集團、上海藥業等,但都婉轉拒絕,因為陸企希望「買斷技術」;目前與浙江當地的藥廠洽談合作,相信很快會有結果。
至於美國方面,除將進行解盲,授權合作也在洽談中。未來若大陸、美國的授權合作洽談順利,美國銷售權利金上看三至四成,而大陸則在6%至12%。
問:MCS-2的市場競爭力?
答:MCS-2是植物藥,第三期臨床試驗自2010年開始收案,在2014年收案完成,去年公布的台灣第三期臨床試驗解盲結果,主要療效指標達到統計的顯著差異,顯現效果及安全性。
到去年為止,FDA已有600多件植物藥新藥的臨床試驗案,MCS-2是唯一的前列腺用藥,目前全球僅有兩家藥廠以植物藥取得藥證,包括治療「菜花」外敷用藥、愛滋病腹瀉用藥,健永的MCS-2可望有機會,名列全球前五名獲美國FDA核准的植物用藥。MCS-2今年的美國臨床三期將會完成解盲,明年會申請美國藥證。
原料備量充足 產銷無虞
問:前列腺、膀胱有關疾病的市場概況?
答:MCS-2主要治療的適應症是「良性前列腺增生」(BPH),可能症狀有排尿不順、頻尿、尿急、夜尿,連帶容易引起膀胱炎、膀胱結石、尿阻流、血尿、腎積水等。
從藥物市場規模來看,歐美日總合約57億美元,大陸約達人民幣45億元。在藥品類型部分,目前前列腺增生用藥分為兩大類,一是甲型阻斷劑,另一種則是五甲型還原酉每抑制劑。甲型阻斷劑的副作用是低血壓、鼻塞、射精困難,而五甲型還原酉每抑制劑的副作用,抑制男性賀爾蒙,藥性效果較慢,也會讓服用者容易有「女性化」的副作用,
問:何謂MCS-2?
答:在生產原料儲備上,MSC-2是以茄科植物萃取的天然用藥,是治療前列腺肥大當前唯一口服、植物藥,而原料方面目前已經儲存五至十年的用量,在產品製造、生產與銷售方面完全沒有問題。
董座郭富鳳 安內攘外
健永生技董事長郭富鳳行事相當低調,很多業界人士聽過此人,但未必見過,都很好奇一個女子如何將困難的植物藥產品從臨床一期做到三期,甚至推向全球市場。資深創投業者觀察,郭富鳳對公司事務專精投入,對關鍵人才的掌握能力更是一流,堪稱人中龍鳳。
郭富鳳在保健食品、藥品的市場深耕超過20年,投入健永的良性前列腺藥增生(BPH)用藥MCS-2開發,也已經有10多年的時間,多年來除了有原始股東持續支持、情義相挺外,該產品能夠解盲成功、進軍美國、中國大陸等地市場,就是因為郭富鳳非常執著。
多數成功人士處事、待人有特別的一套,郭富鳳給人第一眼感覺是典型的家庭主婦,但她溫柔的外表之下卻有剛強的一面,是個能安內攘外的悍將。
根據熟識郭富鳳的人士觀察「她是一位工作狂」。健永資深員工透露,他每天早上8時30分到公司、晚上7時30分下班,而「他到的時候郭董已經到,下班時郭董還沒下班」。有人說,郭富鳳「一天只睡三、四個小時」。
郭鳳富對公司事務專注、投入,工作起來像跑馬拉松,處理事情井然有條、臨危不亂,她對「人」也很有一套,能吸納人才來合作。
資深創投業者觀察,新藥開發有幾個關鍵,包括產品選題、臨床設計、病患收案、醫師買單等,前兩者固然是產品本身的競爭力問題,後兩者則與「醫師」密切相關。郭富鳳總能打動大牌醫師與健永合作,更重要是願意協助病患收案與產品使用,這一點很多人就不容易做到。
評析
健永近期積極洽談大陸藥廠洽談授權,前期權利金至少2,000萬美元起跳。
|
|