本帖最後由 p470121 於 2016-9-15 20:40 編輯
轉貼2016年3月13日經濟日報,供同學參考
懷特…新藥解盲過關 留意獲利
經濟日報 記者 高行
懷特生技旗下術後疼痛新藥PHN131「痛寶」8日解盲過關,是台灣止痛領域新劑型新藥研發成功首例,國際市場規模每年上看30億元,吸引買盤搶進,自8日起連續拉出四支漲停板,上周五(11日)收40.2元,年初來漲幅55.5%。
懷特在1998年創立,當時政府開始投入資源推動生技產業,國內老字號美吾華集團董事長李成家率先響應,找來曾任國際醫藥龍頭必治妥貴寶總經理的陳寬墀攜手創辦懷特,得力於國際知名自然藥物專家中研院院士李國雄協助,鎖定黃耆等中草藥進行先導研究,可稱是國內新藥開發先驅公司。
懷特總裁陳寬墀回憶草創初期,光釐清黃耆中有效成分有其困難度不說,且黃耆多醣結構複雜,純化單一成分並無效果,而是需組合多重成分為單一化合物(SingleCompound)才有效,如何從上萬種組合中篩選出來,有如大海撈針,成為最大挑戰。
懷特研發團隊針對黃耆多醣經過無數次交叉篩選,1998年催生旗下首項新藥PHN012「血寶」,但這仍是挑戰的開始,啟動首期人體臨床試驗後,直到2010年才獲食藥署(TFDA)審核通過,創下國內業界首度拿到處方藥證首例,也是全球唯一治療癌因疲憊症的新藥。
懷特在2002年5月風光上市,但蜜月期短暫,掛牌後二個月間由最高66元腰斬,隔年SARS期間甚至跌破20元,但隨首檔新藥「血寶」在2007年第2季啟動二/三期臨床試驗的預期下,股價4月起連漲一季,7月間衝到76.1元的歷史最高價位。
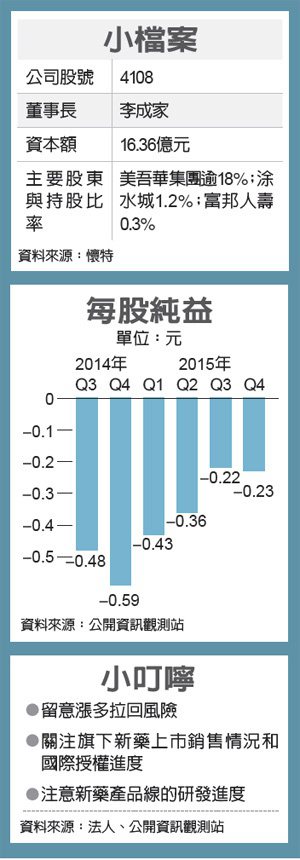
懷特旗下「血寶」在2010年4月順利取得食藥署核發藥證,懷特股價再度急漲一波,之後「血寶」取得對中風等新適應症的研究進展,加上止痛、預防骨質疏鬆、治療腎病變等新藥產品線持續擴充,股價在2012年表現突出,年度漲幅逼近五成。
2014年基亞事件爆發,懷特股價隨生技股整體修正直直落,加上「血寶」在國內上市後,遲遲未對公司獲利產生明顯挹注,股價在去年8月間再次跌破20元,甚至來到12.1元歷史最低價,幾乎進行面額保衛戰,後隨政策利多自谷底回神,近期受第二檔新藥「痛寶」成功解盲激勵,股價再次高飛。
對懷特股價後續發展,法人提醒,懷特新藥「痛寶」解盲成功儘管為實質利多,但該項新藥為「老藥新用」的劑型改良,初期推廣期間恐對獲利挹注有限,且首檔新藥「血寶」自2010年上市後,在無明確實質獲利或權利金入帳情況下,需留意股價短線漲多拉回。
懷特也意識到新藥初期銷售困境,特別組成行銷團隊,擴大醫界使用旗下新藥,並結合臨床醫師經驗發表多篇專業報告,擴大國際能見度。陳寬墀強調「機會留給有準備的人」,對後續銷售抱持高度信心。
評析 懷特新藥「痛寶」解盲成功儘管為實質利多,初期推廣期間恐對獲利挹注有限
|